- mins 13
- 50716
- an opinion
يبحث الجميع اليوم عن أجهزة محمولة لتسهيل مهامهم اليومية. في هذه الحالة، تكون البطاريات قادرة على تلبية الحاجة إلى إنتاج الطاقة في التطبيقات المحمولة. قد تبدو البطاريات صغيرة نسبيًا وبطيئة، لكن هذه البطاريات نفسها يمكن أن تتحول إلى محطة طاقة صغيرة. ليست فكرة إنتاج الطاقة المحمولة شيئًا جديدًا، وحتى إنسان ما قبل التاريخ أنتجها باستخدام الحطب والوقود. يمكن القول إن البطاريات هي أداة فورية لتوفير الطاقة. نريد أن نزوّدكم في هذا المقال بمعلومات عن أشهر أنواع البطاريات، لكن ابقوا معنا لنقرأ نبذة عن تاريخ هذه الأداة.
تاريخ البطاريات
في القرن التاسع عشر، اكتشف أليساندرو فولتا أنه يمكن توليد الكهرباء بشكل مستمر عند استخدام سائل معين كموصل. أدى هذا الاكتشاف إلى بناء أول خلية جهد، وهي البطارية. كان اختراع فولتا للبطارية إيذانًا ببدء حقبة جديدة من اختبارات البطارية. أجرى عدد من العلماء تجارب مختلفة لصنع البطاريات. لكن القليل منهم نجح. أليساندرو فولتا وجون فريدريك دانييل هما العالمان اللذان قاما ببناء خليات فولتا ودانييل على التوالي.
ما هي خلية فولتا؟
تستخدم خلية فولتا التفاعلات الكيميائية لتوليد الطاقة الكهربائية. يتم تصنيع الأنود والكاثود مقابل بعضهما البعض. تحدث الأكسدة عند الأنود وتنخفض عند الكاثود. لإكمال المدار، يتم إنشاء جسر ملح بينهما. تسمى الأجزاء التي تحدث فيها الأكسدة والاختزال شبه الخلايا. یستخدم مدار خارجي أيضًا لتوصيل تدفق الإلكترونات.
ما هي خلية دانييل؟
بعد اختراع خلية فولتا، تم اختراع خلية دانييل وسرعان ما أصبحت معروفة كمصدر للكهرباء. في هذا النوع من الخلايا، يتم تقسيم الحاوية إلى جزأين. يتم إنشاء هذه الفجوة بواسطة غشاء منفذ للأيونات. في جزء واحد، يُغمر قطب الزنك في محلول من كبريتات الزنك وفي الجزء الآخر، يُغمر القطب النحاسي في محلول من كبريتات النحاس. الخلية قادرة على توليد تيار طالما أنها تستهلك النحاس أو كبريتات الزنك. واصل جون دانسر هذه التجربة واخترع أول بطارية بتصميم مسامي.
الكيمياء العامة للبطاريات
تحتوي شتى أنواع البطاريات على ثلاث طبقات من الكاثود والأنود والفاصل. تسمى الطبقة السالبة للبطارية بالقطب الموجب وتسمى الطبقة الموجبة الكاثود. بمجرد إضافة شحنة كهربائية إلى البطارية، يتدفق التيار من القطب الموجب إلى القطب السالب. وبالمثل، عندما نقوم بتوصيل شاحن بــــ بطاريات الأدوات اللاسلكية، يبدأ التيار في التدفق في الاتجاه المعاكس، أي من القطب السالب إلى القطب الموجب.
تعمل كل أنواع البطاريات على أساس تفاعل كيميائي، أي تفاعل الأكسدة والاختزال. يحدث هذا التفاعل بين الكاثود والأنود ومن خلال الفاصل (الإلكتروليت). نتيجة لذلك، يتم شحن القطب سالبًا بسبب تفاعل الأكسدة وهذا القطب يسمى الكاثود. القطب الآخر مشحون بشكل إيجابي بسبب تفاعل الاختزال، والذي يسمى الأنود. عندما يتم غمر معدنين مختلفين في نفس محلول الإلكتروليت، يكتسب أحدهما إلكترونًا ويفقد الآخر إلكترونًا.
نتيجة لذلك، يكتسب أحد المعادن إلكترونًا ويفقد الآخر إلكترونًا. هذا الاختلاف في كثافة الإلكترون للمعدنين يخلق فرق جهد كهربائي بين المعدنين. يمكن استخدام فرق الجهد هذا كمصدر للجهد الكهربائي في أي جهاز كهربائي. تتدفق الأيونات فقط من خلال الفاصل، ويمنع الفاصل كل الحركة من الأنود إلى الكاثود. لذلك، فإن الطريقة الوحيدة لاستقبال التيار الخارجي هي من خلال أطراف البطارية.
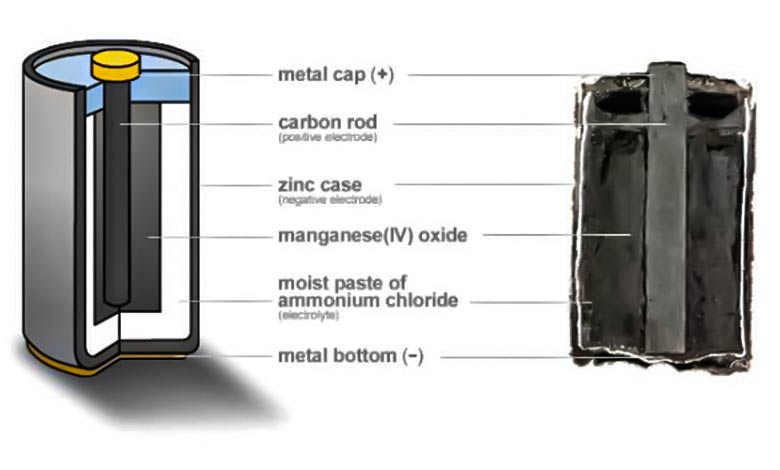
أنواع البطاريات
تستخدم البطاريات بشكل شائع في الأجهزة المنزلية والتطبيقات الصناعية. تم تصميم كل بطارية لغرض معين ويمكن استخدامها حسب الحاجة. تنقسم البطاريات إلى فئتين رئيستين: البطاريات الأولية والثانوية. ومع ذلك، يمكن أيضًا تصنيف البطاريات إلى أربع فئات رئيسية: الخلية الأولية، والخلية الثانوية، وخلية الوقود، والخلية الاحتياطية. هذا ومن ناحية أخرى، هناك أنواع مختلفة للبطاريات نشير إلى أشهرها إضافة إلى ميزاتها ومواصفاتها.
بطارية النيكل والكادميوم
بطاريات النيكل والكادميوم هي نوع من أنواع البطاريات القابلة لإعادة الشحن حيث يتم استخدام أكسيد النيكل والكادميوم كمعدن كأقطاب كهربائية، وهذا هو سبب تسمية هذه البطاريات بالنيكل والكادميوم. مع ذلك، فإن هذه البطاريات لها سعر ومعدل تفريغ أعلى من بطاريات الرصاص الحمضية.

🔵 تتمتع بطارية النيكل والكادميوم بعمر خدمة أفضل بالمقارنة مع البطاريات الأخرى القابلة لإعادة الشحن، ولكن أهم ميزة لها هي توصيل السعة الاسمية حتى عند معدلات التفريغ العالية.
تاريخ بطاريات النيكل والكادميوم
اخترع فلاديمير يونغنر بطاريات النيكل والكادميوم في عام 1899. فقدت هذه البطاريات بسرعة حصتها في السوق في عام 1990 وتم استبدالها ببطاريات النيكل هيدريد والليثيوم أيون.
مع تقدم تكنولوجيا البطاريات في النصف الثاني من القرن العشرين، تم إنتاج البطاريات بأسعار أرخص بكثير، وتوسعت الأجهزة التي تعمل بالبطاريات بشكل كبير لدرجة أنه في عام 2000، تم إنتاج حوالي 1.5 مليار بطارية من النيكل والكادميوم، وکان يتم إنتاجها سنويًا. بحلول منتصف التسعينيات، شكلت بطاريات النيكل والكادميوم غالبية البطاريات القابلة لإعادة الشحن في التطبيقات المنزلية.
هيكل بطاريات النيكل والكادميوم
بطارية النيكل والكادميوم هي بطارية قابلة لإعادة الشحن يستخدم فيها أكسيد النيكل والكادميوم ومحلول هيدروكسيد البوتاسيوم بتركيز 20 إلى 35٪ من الحجم الكلي لمحلول الإلكتروليت. مع زيادة عدد مرات تفريغ البطارية ، يقل عمرها ، لكن بطارية النيكل والكادميوم لها دورة تفريغ أطول من البطاريات الأخرى المماثلة.
تم تقييد إنتاج بطارية النيكل والكادميوم بسبب المخاطر البيئية للكادميوم وتم استبدالها ببطاريات الليثيوم وهيدريد النيكل. تتميز هذه البطارية بكثافة كتلة وحجم أعلى من بطارية حمض الرصاص وهي أغلى ثمناً. عادة ما يتم إنتاج البطاريات التي تحتوي على هذا التركيب الكيميائي في أحجام مختلفة وتستخدم في المكانس والهواتف والمثاقب اللاسلكية، والألعاب القابلة للتحكم.
تطبيقات بطاريات النيكل والكادميوم
يمكن تعبئة خلايا النيكل والكادميوم كخلايا مفردة أو متعددة. يمكن استخدام الخلايا الصغيرة في تطبيقات مثل ألعاب الأطفال أو الأجهزة الإلكترونية المحمولة. تُستخدم بطاريات النيكل والكادميوم بشكل أساسي في الهواتف اللاسلكية وإضاءة الطوارئ وأجهزة الكمبيوتر والألعاب. تُستخدم بطاريات النيكل والكادميوم الكبيرة في السيارات الكهربائية والقوارب وأنظمة الطاقة في حالات الطوارئ وبادئ تشغيل الطائرات.
شحن بطاريات النيكل والكادميوم
يمكن شحن خلايا النيكل والكادميوم بسرعات مختلفة ، اعتمادًا على هيكل البطارية. يتناسب تيار شحن البطارية عادةً مع السعة الاسمية للبطارية ويمكن أن يتراوح من 0.1 أمبيرساعة اسمية إلى 4 أضعاف الساعة الاسمية المقدرة ، على الرغم من أنه نادرًا ما يتم استخدامه.
كلما زاد تيار شحن البطارية ، زادت درجة حرارة البطارية بشكل أسرع. بالطبع ، عملية شحن بطارية النيكل والكادميوم هي عملية ماصة للحرارة ، ولكن عندما تقترب البطارية من الشحن الكامل ، ترتفع درجة حرارتها بسرعة إلى 45 إلى 50 درجة مئوية ، وتلاحظ بعض أجهزة الشحن الشحن الكامل للبطارية من خلال درجة الحرارة وتقوم بتوقف عملية الشحن تلقائیا.
تفريغ بطاريات النيكل والكادميوم
ترتبط سرعة تفريغ بطارية النيكل والكادميوم على حجمها. على سبيل المثال، في الحجم A، يمكن أن تكون سرعة التفريغ 1.8 أمبير ، وبالنسبة للحجم D ، يمكن أن تصل إلى 3.5 أمبير. على سبيل المثال، يمكن استخدام بطارية صغيرة نسبيًا في طائرة أو قارب بحاجة إلی تیار کبیر يصل إلى حوالي 100 أمبير لمدة 5 إلى 6 دقائق لبدء تشغيل المحرك. ومع ذلك ،في التطبيقات التي تتطلب كثافة طاقة عالية، يمكن استخدام بطاريات ليثيوم بوليمر أو بطاريات فوسفات حديد الليثيوم.
بطارية النيكل والمعدن الهجينة
بطارية النيكل والمعدن الهجينة (باختصار: NIMH) هي نوع من أنواع البطاريات القابلة لإعادة الشحن. يشبه التفاعل الكيميائي عند الأقطاب الموجبة تفاعل خلايا النيكل والكادميوم. بالإضافة إلى ذلك، يمكن أن تبلغ سعة بطارية النيكل المعدنية ضعفين إلى ثلاثة أضعاف سعة بطارية النيكل والكادميوم، ويمكن أن تكون كثافة طاقتها قريبة من تلك الموجودة في بطارية ليثيوم أيون.

تطبيقات البطارية النيكل والمعدن الهجينة
بطارية النيكل والمعدن الهجينة مناسبة لأي تطبيق تقريبًا. هذه البطاريات متطورة وغير مكلفة ومثالية للتطبيقات المعقدة. إنها مصممة خصيصًا لمجموعة واسعة من تطبيقات درجة حرارة التشغيل.
تحل تقنية بطاريات النيكل والمعدن محل تقنية بطاريات النيكل والكادميوم المستخدمة في الأجهزة المحمولة والقابلة لإعادة الشحن. تقدم باناسونيك بطاريات قياسية للتطبيقات الشائعة التي توفر قدرًا كبيرًا من الموثوقية في درجات الحرارة المرتفعة والظروف القاسية. تم تصميم هذه البطاريات خصيصًا لتطبيقات الطاقة الشمسية والسيارات والأدوات الكهربائية.
فروق بطاريات النيكل والمعدن الهجينة وبطاريات النيكل والكادميوم
بطاريات النيكل والمعدن الهجينة في وضع أضعف من حيث كثافة الطاقة من بطاريات الليثيوم، ولكن يمكن القول إنها في وضع أفضل مقارنة ببطاريات النيكل والكادميوم. حلت بطاريات النيكل والمعدن الهجينة محل بطاريات النيكل والكادميوم. ميزة هذا النوع من البطاريات على أنواع بطاريات النيكل والكادميوم هي أنها لا تحتوي على ذاكرة شحن. هذا يعني أنه على عكس بطاريات نيكل الكادميوم، يمكن توصيل بطاريات النيكل والمعدن الهجينة بالشاحن في أي وقت.
العمر الافتراضي لبطاريات النيكل المعدنية
يمكن شحن هذه البطاريات بالكامل وتفريغها ما بين 500 و 1000 مرة. يمكن أن يزيد هذا الرقم حتى 4000 مرة من الشحن الكامل والتفريغ، اعتمادًا على جودة الصنع والشركة المصنعة وظروف الصيانة.
بطارية الليثيوم يون
تعد بطارية الليثيوم أيون، وباختصار lithium-ion battery أو Li-ion battery، نوعًا من أنواع البطاريات القابلة لإعادة الشحن التي تُستخدم بشكل شائع في الإلكترونيات المحمولة والسيارات الكهربائية وتزداد شعبيتها كل يوم لاستخدامها في مختلف الصناعات بما في ذلك الصناعة العسكرية وكذلك صناعة الطيران. تولد بطاريات الليثيوم أيون، مثل البطاريات الأخرى، تيارًا مستمرًا باستخدام التفاعلات الكيميائية. عندما يتم شحن البطارية وتفريغها يتم نقل أيونات الليثيوم بين الأقطاب الموجبة والسالبة (الكاثود والأنود).
تولّد بطاريات الليثيوم أيون مثل أنواع البطاريات الأخرى تيارًا مستمرًا باستخدام التفاعلات الكيميائية. عندما يتم شحن البطارية وتفريغها، يتم نقل أيونات الليثيوم بين الأقطاب الموجبة والسالبة (الكاثود والأنود). بشكل عام، تعتمد مكونات الكاثود على أكاسيد معادن الكوبالت والنيكل والمنغنيز وهي عبارة عن أنودات من الجرافيت.

يتم تصنيع كل من الكاثود والأنود باستخدام هيكل متعدد الطبقات مع أيونات الليثيوم بينهما. عندما يتم شحن بطاريات أيونات الليثيوم، تنتقل أيونات الليثيوم من القطب السالب إلى القطب الموجب، وعندما تكون البطارية قيد الاستخدام، أو في الواقع عند تفريغ البطارية تنتقل أيونات الليثيوم من القطب الموجب إلى القطب السالب.
أدى الاستخدام المتزايد للإلكترونيات المحمولة بين الجمهور، مثل الهواتف المحمولة وأجهزة الكمبيوتر المحمولة، إلى زيادة الطلب على البطاريات القابلة لإعادة الشحن، ومن بينها بطاريات الليثيوم أيون التي تتمتع بأداء وكفاءة أفضل من أنواع البطاريات الأخرى وتنتج أكثر بالمقارنة معها.
تاریخ بطاريات الليثيوم
تم تقديم أول بطاريات الليثيوم من قبل جي.ان.لوييس في عام 1912 ولكن لم يتم طرح أول بطاريات الليثيوم القابلة لإعادة الشحن في السوق إلا في السبعينيات. في عام 1985 ، صنع أكيرا يوشينو نموذجًا أوليًا لبطارية ليثيوم أيون ، بناءً على بحث سابق أجراه عدد من العلماء في عام 1991 تحت قيادة يوشيو نيشي.
الليثيوم هو أخف معدن من بين جميع العناصر وله أعلى جهد كهروكيميائي وينتج أعلى كثافة للطاقة بالنسبة لوزنه. الليثيوم نشط للغاية ومتفاعل ، لذلك لا يوجد بحرية في الطبيعة. قدمت شركة سوني في عام 1991، أول بطارية ليثيوم أيون وبعد ذلك، رحبت بهذا المنتج الشركات الكبرى واحدة تلو أخرى.
كيف تعمل بطارية الليثيوم أيون؟
تتكون بطاريات الليثيوم أيون، مثل أنواع البطاريات الأخرى، من خلايا كهروكيميائية ذات قطبين كهربائيين وإلكتروليت واحد. في عملية شحن بطاريات الليثيوم أيون في القطب الموجب، يتم تحويل الليثيوم إلى أيون الليثيوم الموجب وفي القطب السالب أيون الليثيوم إلى الليثيوم المعدني وثم يتم وضعه بين طبقات القطب. تم إجراء أبحاث كثيرة لتطوير كل من الأقطاب الكهربائية والإلكتروليتات في بطاريات أيونات الليثيوم، ومع إدخال المواد النانوية في هذا البحث، حدثت تغييرات جذرية في أداء بطاريات الليثيوم ويستمر هذا التطور بإنتاج مواد نانوية جديدة.
يتم تخزين طاقة بطارية ليثيوم أيون وإطلاقها، مثل أنواع البطاريات الأخرى، عن طريق نقل الإلكترونات من طرف إلى آخر. عادة في بطاريات الليثيوم أيون، يكون الطرف الموجب للبطارية مصنوعًا من الألومنيوم والطرف السالب للبطارية مصنوع من النحاس. عندما يتم إعادة شحن البطارية بالكامل، تتراكم جميع أيونات الليثيوم حول القطب الموجب أو القطب السالب. السائل الموجود داخل البطارية يسمى الإلكتروليت. تتدفق هذه المادة بين قطبين كهربائيين للبطارية. في بطاريات الليثيوم أيون، يحتوي هذا السائل على أيونات الليثيوم.
ميزات بطارية الليثيوم أيون
عادة ما تكون كثافة الطاقة لبطاريات الليثيوم أيون ضعف تلك الموجودة في بطاريات النيكل والكادميوم، وتكون الإمكانات أعلى من ذلك بكثير. تتمتع هذه البطاريات بخصائص شحن جيدة وتعمل بشكل مشابه جدًا لنيكل كادميوم من حيث التفريغ. يسمح الجهد العالي للخلية (فرق الحمل بين قطبين) بقدر 3.6 فولت باستخدام خلية واحدة في تصميم البطارية. الخلية عبارة عن أنود وكاثود يفصل بينهما إلكتروليت.
تحتوي معظم الهواتف المحمولة اليوم على بطاريات أحادية الخلية، بينما بالنسبة لبطارية النيكل، يجب عليك توصيل ثلاث خلايا بقوة 1.2 فولت على التوالي. تتطلب بطاريات الليثيوم أيون أقل قدر من الصيانة، وهذه ميزة لا يمكن أن تدعيها أنواع البطاريات الكيميائية الأخری.
لا تحتوي هذه البطارية على ذاكرة الشحن ولا يلزم وجود دورة مبرمجة لإطالة عمر البطارية. بالإضافة إلى ذلك، فإن التفريغ التلقائي لبطاريات الليثيوم أيون أقل من نصف تفريغ النيكل والكادميوم، مما يجعله مناسبًا جدًا لتطبيقات قياس الوقود. الأهم من ذلك، أن أيونات الليثيوم تسبب ضررًا طفيفًا جدًا للطبيعة بعد التخلص منها.
هذه البطاريات تتميز بكثافة طاقة عالية ولاتحتاج إلى الشحن طويل الأمد في الاستخدام الأول. يتم تفريغ شحن هذا النوع من البطاريات تلقائيا ومنخفضا نسبيا ولاتحتاج إلى التفريغ الدوري. هذا ويمكن لفئة خصة من بطاريات الليثيوم أيون أن توفر تيارا عاليا جدا لتطبيقات مثل تشغيل الأدوات الكهربائية.
FAQ :
🔘 ما هي أنواع البطاريات؟
البطارية أداة لها أنواع مختلفة، إلا أن بطاريات الليثيوم هي التي تستخدم اليوم أكثر بالنسبة لأنواع البطاريات الأخرى.
🔘 ما هي خلية البطارية؟
الخلية عبارة عن أنود وكاثود يفصل بينهما إلكتروليت.
🔘ما هي ميزات بطارية الليثيوم يون؟
كثافة طاقة عالية، تفريغ شحن تلقائي منخفض نسبيًا، عدم الحاجة التفريغ الدوري، عدم الحاجة إلى الشحن طويل الأمد في الاستخدام الأول، إمكانية توفير تيار عالي لتشغيل الأدوات الكهربائية، الضرر الطفيف للطبيعة بعد التخلص منها.
الختام :
اليوم، يبحث كثير من الناس عن أجهزة محمولة لأنها تسهّل مهامهم اليومية. الحل الوحيد لهذا الغرض هو استخدام البطاريات في الأدوات المحمولة. قد تبدو البطاريات صغيرة نسبيًا وبطيئة، لكن هذه البطاريات نفسها يمكن أن تتحول إلى محطة طاقة صغيرة. يمكن أن نقول إن البطارية هي وسيلة فورية لتوفير الطاقة وقد قمنا بتزويد القراء الكرام في هذا المقال بمعلومات عن أنواع البطاريات الشهيرة وهي بطاريات النيكل والكادميوم، النيكل والمعدن الهجينة والليثيوم أيون.

Ronix
12 ديسمبر 2021










شكرا لهذه المادة